unidad 5
EL ENLACE QUIMICO

El enlace químico es la fuerza que une a los atomos para formar las moléculas.
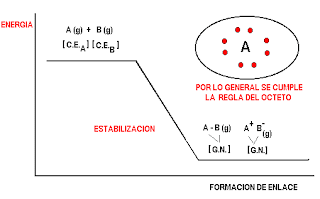
Como ya se ha dicho es un proceso de estabilización por interacciones electrónicas donde cada átomo trata de alcanzar la configuración electrónica del gas noble más cercano. Por lo general los gases nobles tienen 8 electrones de valencia, de allí se acostumbra a decir que el enlace químico se forma cumpliendo la "regla del octeto".
La energía de estabilización se denomina también la energía de enlace y corresponde además de la energía liberada cuando se forma el enlace a la energía necesaria para romper el enlace.
TIPOS DE ENLACES Y POLARIDAD DE LOS ENLACES
Existen dos mecanismos para cumplir la regla del octeto.
-
ENLACE IONICO. Cesión de electrones, de parte de un átomo fuertemente electropositivo a otro fuertemente electronegativo. Formación de iones positivos y negativos y atracción electrostática entre ellos.
-
ENLACE COVALENTE. Compartición de parejas de electrones entre átomos de parecida o igual electronegatividad. Electrones compartidos con spines opuestos y atracción magnética.
ENLACE COVALENTE DATIVO Y CARGAS FORMALES
Se presenta con relativa frecuencia la situación que para formar un enlace covalente o de compartición, es uno de los átomos participantes del enlace el que aporta la pareja de electrones del enlace. El enlace que se forma se llama covalente dativo y va acompañado de desbalances de cargas eléctricas que deben ser determinados para tener una clara visión de la situación molecular.
Los desbalances de cargas eléctricas se detectan mediante el cálculo de las cargas formales haciendo uso de la siguiente relación:
CF = N° de electrones de valencia - ( N° electrones no enlazantes + 1/2 N° electrones enlazantes )
LA RESONANCIA ELECTRÓNICA
" Cuando para una molécula se puede escribir varias varias configuraciones de Lewis correctas ( sin cambiar de posición los átomos) , la verdadera configuración es una mezcla de todas ellas que se denomina hibrido de resonancia y dónde la importancia de cada estructura contribuyente es proporcional a sus estabilidad."
Reglas de la resonancia electrónica
1).- Al escribir estructuras resonantes se desplazan electrones y nunca átomos.
2).- Todas las formas resonantes del híbrido deben tener el mismo número de electrones apareados.
3).- Las estructuras con mayor número de enlaces son más contribuyentes. La estructuras con cargas eléctricas son menos contribuyentes.

5).- Las estructuras con cargas de distinto signo más próximas, son más contribuyentes.
6).- Las estructuras con cargas de igual signo muy próximas, tienen poca contribución.
EL ENLACE QUÍMICO Y LA MECANICA CUANTICA
La Mecánica Cuántica contempla la combinación matemática de las funciones de ondas de orbitales atómicos para dar orbitales moleculares ( pertenecen a la molécula). La combinación produce dos orbitales moleculares.
ENERGÍA DE LOS ORBITALES MOLECULARES ENLAZANTES Y ANTIENLAZANTES EN FUNCIÓN DE LA DISTANCIA INTERATÓMICA
TIPOS DE UNIONES
Los gráficos siguientes además de reforzar los conceptos de orbitales moleculares enlazantes y antienlazantes y sus implicancias desde el punto de vista de la energía nos muestran dos situaciones que apuntan más bién al tipo de orbitales que intervienen o a distintas formas de unión.
TIPOS DE ENLACES Y UNIONES

GEOMETRÍA MOLECULAR
La disposición de los átomos en el espacio se determina experimentalmente mediante la técnica de difracción de rayos X. Para hacer concordar la información experimental con aspectos teóricos se ha visto la necesidad de formular un modelo de reordenamiento posicional de los orbitales atómicos. Esta formulación de orden matemático se conoce como hibridación de los orbitales atómicos (mezcla matemática de funciones de onda). Existen diferentes formas de hibridación y la forma que en definitiva adopte un átomo decidirá la orientación espacial de sus orbitales y por consecuencia la GEOMETRIA MOLECULAR .



CRITERIOS PARA DECIDIR LA HIBRIDACIÓN
Hay que observar la multiplicidad de los enlaces, esto es, cuántas uniones pi deben formarse. Para cada unión pi un átomo debe disponer un orbital p.
2.-CRITERIO DE REPULSIÓN DE PAREJAS DE ELECTRONES
Las parejas de electrones, ya sean enlazantes o bién no enlazantes, se repelen por tener igual carga. Entonces el criterio obliga a dar el máximo ángulo de separación a todas las parejas de electrones.
En los graficos siguientes los electrones del átomo cuya hibridación tratamos de determinar los representamos como puntos azules y los electrones del átomo vecino con el que se enlaza como puntos rojos. Así, las parejas enlazantes se grafican como puntos azul y rojo indicando electrones que pertenecen al átomo en cuestión y al otro átomo respectivamente y las no enlazantes del átomo como un par de puntos azules.
UNIDAD 6
PROPIEDADES FISICOQUIMICAS
DE LAS SUSTANCIAS PURAS
Los tipos de enlaces, la direccionalidad de éstos, los rasgos eléctricos y otras características moleculares determinan las propiedades fisicoquímicas de las sustancias.
Parece conveniente referirse en éste momento a la fortaleza comparada de los distintos tipos de enlaces interatómicos. La fortaleza del enlace está dada por la energía necesaria para romper el enlace y ésta a su vez es directamente proporcional a la energía de estabilización o energía liberada cuando el enlace se forma.
MOLECULAS GIGANTES
Son arreglos de átomos, unidos mediante fuerzas de enlace químico (interatómico), en que no está definido el tamaño del sistema. Por lo general son arreglos de gran tamaño y de allí el nombre de la categoría. La proporción de distintos átomos se conoce y se representan estos sistemas por su fórmula empírica. La fórmula verdadera es (F.E.) n , pero n es indeterminada.
Hay tres grandes tipos de moléculas gigantes, las de enlace iónico, las de enlace covalente y las de enlace metálico.
COVALENTES TRIDIMENSIONALES
Son arreglos tridimensionales de átomos iguales o diferentes unidos por enlaces covalentes y dispuestos en el espacio siguiendo las reglas de la hibridación. Son las estructuras más rígidas, duras o resistentes que se conocen.
Sus temperaturas de fusión son muy altas ( miles de°C) y en muchos casos se descomponen químicamente por el calor antes de entrar en fusión. Por otra parte la separación de las partículas por acción de moléculas de un solvente es imposible, por lo tanto son completamente insolubles.
El Carbono en su forma de diamante ( hibridación sp3 ) es un ejemplo típico de ésta categoría. Las láminas de Silicio de la nariz del Discovery son otro ejemplo.

COVALENTES BIDIMENSIONALES
Es cuando la red de enlaces covalentes se teje en dos dimensiones. Los mismos conceptos de infusibilidad e insolubilidad que para las mallas trididimensionales pero no así en lo que se refiere a la dureza pues las fuerzas de atracción entre las mallas bidimensionales es débil. Por esa razón estas sustancias son blandas en el sentido del desprendimiento de las mallas.
El ejemplo típico es el Carbono en su forma de grafito en que los C están hibridizados sp2 . Es interesante consignar que en cada orbital pz existen un electrón. Estos electrones se pueden desplazar sobre la malla y en consecuencia el grafito es conductor de la corriente eléctrica.

COVALENTES UNIDIMENSIONALES
Corresponde a las sustancias denominadas polímeros, largas cadenas de unidades conectadas por enlaces covalentes.
Los homopolímeros que repiten unidades iguales (-A-A-A-A-A-A- ; -(A)- n ).
Los copolímeros que repiten unidades distintas ( A-B-A-B-A-B- ; ( -A-B-) n ).
Son cadenas largas llamadas también macromoléculas y por ésta razón es que interaccionan unas con otras de manera significativa. Las interacciones entre macromoléculas son fuerzas de distintos tipos y que veremos más adelante en el caso de moléculas pequeñas.
En los polímeros, en primer término, la fusión y la solubilización están determinadas por la magnitud de las fuerzas de atracción entre las macromoléculas, en principio altas, precisamente por la longitud de las cadenas. Sin embargo, existe un segundo factor determinante, el factor entrópico o desorden que pueden alcanzar las estructuras una vez solubilizadas o fundidas.
Los polímeros flexibles o plegables forman estructuras sólidas bifásicas (cristalinas – amorfas) que son quebradizas, éstas estructuras se pueden disolver o fundir con relativa facilidad pues cuando alcanzan tales estados la macromoléculas están muy enroscadas, plegadas u ovilladas, en suma desordenadas lo que favorece el proceso de separación de las macromoléculas.
IONICAS.
En estas moléculas gigantes los átomos están unidos por enlaces iónicos. Es decir son un arreglo de iones positivos y negativos que se disponen alternadamente en el espacio compensando sus cargas . La geometría del arreglo es simple cuando los iones positivos y negativos son monoatómicos y además se encuentran en relación 1:1 como en el caso del Na+Cl -. Cuando los iones son complejos, con grandes diferencias de tamaños o la proporción entre ellos no es simple, los arreglos son complicados y son materia de estudio de la Cristalografía que hace uso de las técnicas de difracción de rayos X para resolver estas situaciones.
METALICAS
Corresponde al caso de los metales. Los átomos metálicos , al ser muy electropositivos se desprenden de sus electrones de valencia pasando a formar iones positivos. Por su parte los electrones que han perdido su pertenencia a un átomo determinado se mueven entre los iones constituyendo una nube de electrones delocalizados. Esta nube de electrones que une a iones positivos es el enlace metálico.
MOLECULAS CONVENCIONALES O SUSTANCIAS MOLECULARES
Son aquellos sistemas formados por moléculas que se encuentran claramente definidas, se conoce el número exacto de átomos y de qué elementos está constituída la molécula. Se representan por las llamadas fórmulas moleculares reales.
En su gran mayoría las moléculas de ésta categoría unen sus átomos con enlaces covalentes y al expresar esto pensamos en muchas moléculas simples formadas entre no metales y en la inmensa cantidad de compuestos orgánicos constituídos principalmente por los elementos C, H, O, N, P, S.
Sin embargo al momento de racionalizar las propiedades fisicoquímicas de este tipo de estructuras, el tipo de enlace interatómico ( covalente) y su fortaleza no cuenta pués en este caso lo determinante son las fuerzas entre moléculas o fuerzas intermoleculares y en algunos casos son fuerzas intramoleculares ( fuerzas dentro de las moléculas; pero no interatómicas o de enlace químico ) las determinantes de las propiedades.
En todo caso las fuerzas intermoleculares son de naturaleza eléctrica, pero las hay de diferente naturaleza y magnitudes pero siempre dependen en definitiva de las características eléctricas, del tamaño y geometría de las moléculas.
En los comentarios generales cabe señalar que estos sistemas no conducen la corriente eléctrica en ningún estado físico y también son malos conductores del calor.
Las fuerzas de Van der Waals son comparativamente las fuerzas intermoleculares de menor intensidad pero pueden existir grandes diferencias de sus magnitudes entre moléculas que las poseen como único factor de atracción.
Estas diferencias pueden ocasionarse por :
a) por significativa diferencia del tamaño de las moléculas.
b) por la presencia de átomos de mucha diferencia en la cantidad de electrones o de muy distinta polarizabilidad electrónica.
c) por la circunstancia de presentar una geometría muy diferente.